学术动态 | 检验医学院王健宇团队揭示肺癌干细胞通过外泌体传递长非编码RNA Mir100hg激活H3K14乳酰化促进非干性肺癌细胞转移潜力
2025年2月28日,重庆医科大学检验医学院王健宇副研究员、超声医学工程国家重点实验室邢若曦教授以及重庆市妇幼保健院(重庆医科大学附属妇女儿童医院)李竞宇研究员团队合作在国际学术期刊Journal of Nanobiotechnology上发表了题为Exosomal lncRNA Mir100hg from Lung Cancer Stem Cells Activates H3K14 Lactylation to Enhance Metastatic Activity in Non-Stem Lung Cancer Cells的研究论文。该研究首次揭示了肺癌干细胞通过外泌体传递长链非编码RNA Mir100hg,激活H3K14乳酰化,从而增强非干性肺癌细胞转移能力的全新机制,为理解肿瘤细胞异质性群体间的通讯提供了新视角。

在该研究中,作者通过多组学测序和实验验证,首次证明肺癌干细胞(CSCs)分泌的外泌体长链非编码RNA Mir100hg能够显著增强非干性肺癌细胞的体外迁移侵袭能力和体内转移潜能。机制研究表明,在肺癌干细胞中,HNRNPF与Mir100hg直接结合,促进其从细胞核向细胞质转运,而HNRNPA2B1则进一步促进Mir100hg进入外泌体。在非干性肺癌细胞中,Mir100hg通过两种机制上调果糖二磷酸醛缩酶 A(ALDOA)表达:一方面作为竞争性内源RNA(ceRNA)靶向miR-15a-5p/31-5p;另一方面招募去泛素化酶OTUD4,阻断ALDOA的泛素化降解。ALDOA表达增加导致细胞内乳酸水平升高,促进了组蛋白H3K14乳酰化,进而增加与转移相关基因的表达,最终增强非干性肺癌细胞的转移能力。值得注意的是,通过多组学分析,作者鉴定了一系列受Mir100hg-H3K14乳酰化轴调控的转移相关基因,包括Lman1、Ostc、P4ha1、Tex30和Tmem65,它们与肺腺癌患者的不良预后密切相关。
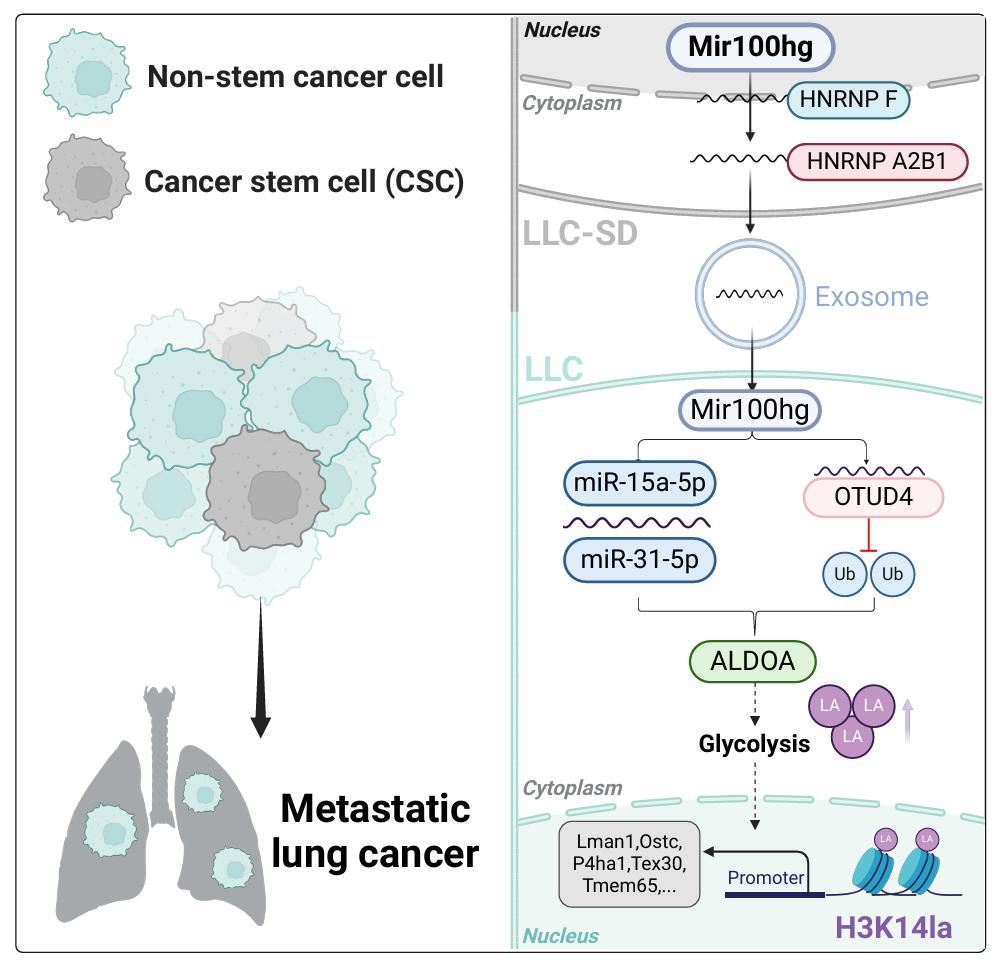
综上所述,该研究首次揭示了肺癌干细胞如何通过外泌体Mir100hg传递将其高转移活性转移给非干性肺癌细胞的复杂调控网络,建立了代谢重编程与表观遗传调控之间的联系,为理解肿瘤异质性细胞间的通讯机制提供了新见解,也为肺癌转移治疗提供了潜在靶点。
原文链接:https://doi.org/10.1186/s12951-025-03198-0
撰稿:王健宇 |
排版:曾建川 |
审核:曾建川、李洁、胡小蕾 |